Crecimiento poblacional de Brachionus quadridentatus Hermann, 1783 (Rotífera) aplicando tres dietas
DOI:
https://doi.org/10.51252/revza.v4i2.868Palabras clave:
Chlorella, macambo, producción masivaResumen
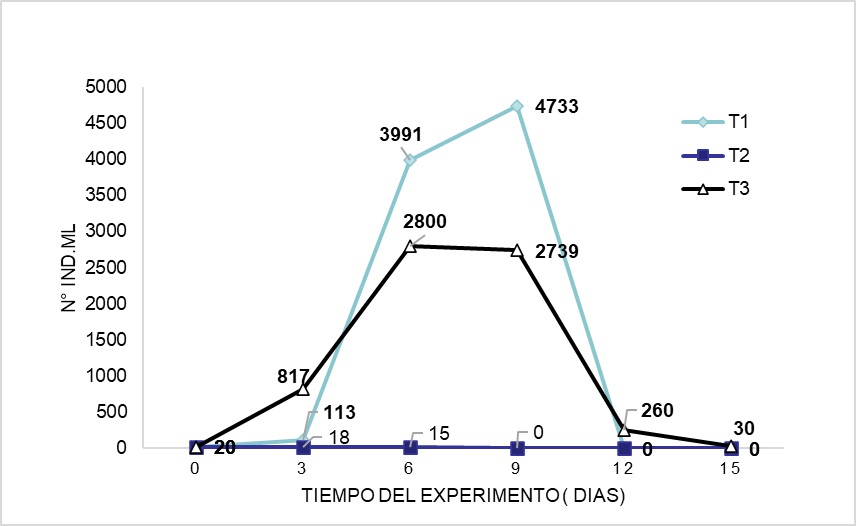
Brachionus quadridentatus Hermann, 1783 es una especie de rotífero común en aguas continentales utilizados en la acuicultura para la producción masiva, el presente estudio tuvo como objetivo evaluar diferentes dietas en el crecimiento poblacional de esta especie en condiciones controladas. El cultivo se realizó en nueve matraces de 500 mL y volumen útil de 400 mL de agua filtrada donde se sembraron 20 rotíferos por matraz y fueron alimentados con Chlorella sp. a una concentración de 1,8 x 106 cel (T1), harina de Theobroma bicolor “macambo”, 50 mg/ml (T2) y la mezcla de ambos (T3), todos por triplicado, durante 15 días. Diariamente se realizó conteo de los rotíferos y se evaluaron los parámetros de crecimiento poblacional. Los parámetros de calidad de agua estuvieron dentro de los rangos adecuados para el desarrollo de la especie. Los valores poblacionales más elevados fueron con Chlorella sp. (productividad de 421 ± 78,52 ind. mL-1, tasa de crecimiento de 0,38 ± 0,01 día, tiempo de duplicación de 1,81 ± 0,06 día y con una densidad máxima de organismos de 6,345 ind. mL-1). Los mejores parámetros de crecimiento poblacional fueron con el uso solo de la microalga Chlorella sp.
Descargas
Citas
FAO. El estado mundial de la pesca y la acuicultura 2020. Food and Agriculture Organization of the United Nations; 2020. Disponible en: http://www.fao.org/documents/card/en/c/ca9229es
PRODUCE. Anuario estadístico pesquero acuícola 2020 [Internet]. Ministerio de la Producción; 2021. p. 185. Disponible en: https://www.producempresarial.pe/anuario-estadistico-pesquero-y-acuicola-2020/
Hernandez Ayala MC, Ruiz Martínez RJ. Crecimiento poblacional y fecundidad de Brachionus Ibericus alimentado con Microalgas [Internet]. Universidad de Córdoba; 2021. Disponible en: https://repositorio.unicordoba.edu.co/handle/ucordoba/3964
Stelzer CP. Evolution of Rotifer Life Histories. Hydrobiologia [Internet]. septiembre de 2005;546(1):335-46. Disponible en: http://link.springer.com/10.1007/s10750-005-4243-x
Jeeja PK, Joseph I, Raj RP. Nutritional composition of rotifer (Brachionus plicatilis Muller) cultured using selected natural diets. Indian J Fish [Internet]. 2011;58(2):59-65. Disponible en: https://epubs.icar.org.in/index.php/IJF/article/view/7324
Kumar R, Kumar A, Sharma R, Baruwa A. Pharmacological review on Natural ACE inhibitors. Sch Res Libr [Internet]. 2010;2(2):273-93. Disponible en: https://www.researchgate.net/profile/Dr-Ram-Sharma/publication/283294239_Pharmacological_review_on_Natural_ACE_inhibitors/links/5631060508ae0530378cff84/Pharmacological-review-on-Natural-ACE-inhibitors.pdf
Sarma S, Fernández Araiza MA, Nandini S. Competition between Brachionus calyciflorus Pallas and Brachionus patulus (Müller) (Rotifera) in relation to algal food concentration and initial population density. Aquat Ecol [Internet]. 1999;(33):339–345. Disponible en: https://link.springer.com/article/10.1023/A:1009912816400
Awaïss A, Kestemont P. Feeding sequences (rotifer and dry diet), survival, growth and biochemical composition of African catfish, Clarias gariepinus Burchell (Pisces: Clariidae), larvae. Aquac Res [Internet]. octubre de 1998;29(10):731-41. Disponible en: http://doi.wiley.com/10.1046/j.1365-2109.1998.29100731.x
Eddy S, Hodson AC. Taxonomic keys to the common animals of the north central states (Exclusive of the parasitic worms, inserts and birds). 3.a ed. GoodReads; 1982. 285 p.
Pennak RW. Fresh-Water Invertebrates of the United States. 2.a ed. New York, USA; 1978. 822 p.
Rioboo C, Prado R, Herrero C, Cid A. Population growth study of the rotifer Brachionus sp. fed with triazine-exposed microalgae. Aquat Toxicol [Internet]. agosto de 2007;83(4):247-53. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0166445X07001555
Cisneros R. Rendimiento poblacional del rotífero nativo brachionus sp. “Cayman”, utilizando diferentes enriquecedores. Ecol Apl. 2011;10(1-2):99. Disponible en: https://doi.org/10.21704/rea.v10i1-2.419
Odo GE, Agwu JE, Iyaji FO, Madu JC, Ossai NI, Allison LN. Mass production of rotifer (Branchionaus calyciflorus) for aquaculture in south-eastern Nigeria. Int J Fish Aquac [Internet]. 24 de septiembre de 2015;7(9):151-9. Disponible en: http://academicjournals.org/journal/IJFA/article-abstract/4228CEE55452
Kennari A, Ahmadifard N, Seyfabadi J, Kapourchali M. Comparación del crecimiento y la composición de ácidos grasos del rotífero de agua dulce, Brachionus calyciflorus Pallas, alimentado con dos tipos de microalgas en diferentes concentraciones. Foof Agric Organ. 2008;39(2):235-42.
Prieto M, Espitia G. Proporción Óptima de alimneto en el mantenimiento de la cepa del rotíferoBrachionus patulus (Müller) 1786), bajo condiciones de laboratorio. Rev MVZ Córdoba [Internet]. 2001;6(1):37-42. Disponible en: https://www.redalyc.org/pdf/693/69360106.pdf
Espinoza-Barrera U, Flores-Arizmendi A, González-Pérez A, González-Velasco C, Castro-Mejía J, Castro-Mejía G, et al. Laboratory controlled production of Brachionus patulus Müller 1786 , using three green unicellular microalgae as food . Rev Digit del Dep El Hombre y su Ambient [Internet]. 2014;1(5):10-6. Disponible en: http://cbs1.xoc.uam.mx/e_bios/docs/2014/02_BRACHIONUS_PATULUS_ENGLISH.pdf
Orozco-Rojas D, Cardoso-Parra A, Castro-Mejía G. Estudio comparativo de la densidad poblacional de Brachionus plicatilis (Mueller, 1786), alimentado con microalgas y Selco (HUFA) cultivados a 10g L-1 de salinidad en laboratorio. Rev Digit del Dep el hombre y su Ambient [Internet]. 2012;1(1):6-12. Disponible en: https://www.academia.edu/32263821/Estudio_comparativo_de_la_densidad_poblacional_de_Brachionus_plicatilis_Mueller_1786_alimentado_con_microalgas_y_Selco_HUFA_cultivados_a_10_gL_1_de_salinidad_en_laboratorio
Torres-Valencia GA, Imués-Figueroa MA, Sanguino-Ortiz WR, Chapman FA. Aislamiento de una Cepa de rotifero de agua dulce con potencial como alimento vivo en acuicultura. Rev Investig Pecu [Internet]. 30 de junio de 2018;5(1):25-32. Disponible en: http://revistas.udenar.edu.co/index.php/revip/article/view/3096
Rosas J, Cabrera T, Millán J. Efecto de la Dieta en el Crecimiento Poblacional del Rotifero, Brachionus plicatilis (M. 1786), Cepa Us. En: Proceedings of the Gulf and Caribbean Fisheries Institute. AquaDocs; 1998. p. 634-9.
Ajah PO. Mass culture of Rotifera (Brachionus quadridentatus [Hermann, 1783]) using three different algal species. Food Sci [Internet]. 2010;4(5):80-5. Disponible en: https://academicjournals.org/journal/AJFS/article-abstract/E74CBA721775
Suantika G, Dhert P, Sweetman E, O’Brien E, Sorgeloos P. Technical and economical feasibility of a rotifer recirculation system. Aquaculture [Internet]. noviembre de 2003;227(1-4):173-89. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0044848603005027
Lavens P, Sorgeloos P. Manual on the production and use of live food for aquaculture. 1.a ed. Fisheries Technical Paper; 1996. 295 p.
Lubzens E. Raising rotifers for use in aquaculture. Hydrobiologia. abril de 1987;147(1):245-55. Disponible en: https://doi.org/10.1007/BF00025750
Rodríguez-Estrada J, Villaseñor-Córdova R, Martínez-Jerónimo F. Efecto de la temperatura y tipo de alimento en el cultivo de Moina micrura (Kurz, 1874) (Anomopoda: Moinidae) en condiciones de laboratorio. Hidrobiológica [Internet]. 2003;13(3):1-7. Disponible en: https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0188-88972003000300007
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2024 Rosa Angélica Ismiño-Orbe, Christian Fernández-Méndez, Pedro Ramírez-Arrarte, Miriam Alván -Aguilar, German A. Murrieta-Morey

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Los autores retienen sus derechos:
a. Los autores retienen sus derechos de marca y patente, y tambien sobre cualquier proceso o procedimiento descrito en el artículo.
b. Los autores retienen el derecho de compartir, copiar, distribuir, ejecutar y comunicar públicamente el articulo publicado en la Revista de Veterinaria y Zootecnia Amazónica (REVZA) (por ejemplo, colocarlo en un repositorio institucional o publicarlo en un libro), con un reconocimiento de su publicación inicial en la REVZA.
c. Los autores retienen el derecho a hacer una posterior publicación de su trabajo, de utilizar el artículo o cualquier parte de aquel (por ejemplo: una compilación de sus trabajos, notas para conferencias, tesis, o para un libro), siempre que indiquen la fuente de publicación (autores del trabajo, revista, volumen, numero y fecha).






