Relación inversa entre el número de extracciones sanguíneas y la fragilidad osmótica eritrocitaria en carneros
DOI:
https://doi.org/10.51252/revza.v5i2.1190Palabras clave:
almacenamiento de sangre, bienestar animal, sangre de coderoResumen
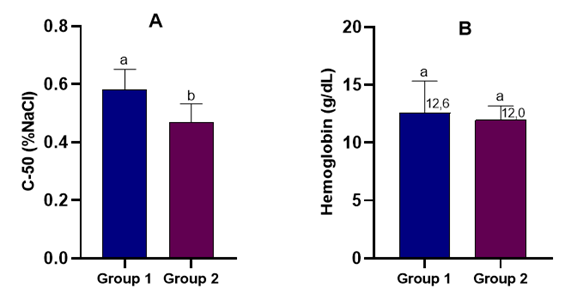
La sangre de carnero es un reactivo biológico importante para los laboratorios clínicos y microbiológicos. Es esencial mantener la integridad celular de sus eritrocitos cuando se utiliza en reacciones hemolíticas en protocolos de diagnóstico. El objetivo del presente trabajo fue determinar la relación entre el número de extracciones de sangre en carneros y la fragilidad osmótica eritrocitaria, y su correlación con el tiempo de almacenamiento de la sangre a (2-8)°C, con su robustez térmica 16 h a temperatura de laboratorio (22-25) °C, y con el bienestar y el comportamiento de los carneros. Los experimentos revelaron que la fragilidad osmótica eritrocitaria está inversamente relacionada con el número de extracciones de sangre. La concentración de hemoglobina se mantuvo en el rango normal hasta seis extracciones de sangre, y no cambiaron los indicadores de bienestar ni del comportamiento animal. Los eritrocitos mantuvieron su integridad osmótica durante 42 días de almacenamiento a (2-8) °C y hasta 16h a (22-25) °C. Este trabajo ha demostrado, por primera vez, la resistencia de la sangre de carnero a la hemólisis, tras repetidas extracciones de sangre al mismo animal o exposición a temperaturas subóptimas, lo que la confirma como un reactivo fiable en los procedimientos diagnósticos rutinarios.
Descargas
Citas
Chacón AV. Evaluation of ram blood as nutritive supplement in culture media: citratated and defibrinated. MediSan. [Internet] [Accessed 4 Sep 2025]. 2021; 25(03). Available in: https://www.medigraphic.com/cgi-bin/new/resumenI.cgi?IDARTICULO=109221
Očenáš P, Baloga M., Valko-Rokytovská M, Ivašková S. Determination of Biochemical and Metabolomic Characteristics of Sheep Blood Serum and Their Application in Clinical Practice. Life [Internet]. 2025; 15(7):1141. Available in: https://doi.org/10.3390/life15071141
Chabannes M, Bordereau P, Martins PV, Dragon-Durey M.A. Sheep Erythrocyte Preparation for Hemolytic Tests Exploring Complement Functional Activities. In: Roumenina, L.T. (eds) The Complement System. [Internet] 2021; Methods in Molecular Biology, vol. 2227. Humana, New York, NY. Available in: https://doi.org/10.1007/978-1-0716-1016-9_6
Thualfakar HHA, Abdul Hussein A, Almahbob TF. Review of Streptococcus pyogenes. Qeios. [Internet] 2023. Available in: https://doi.org/10.32388/BCSYBU.2
Tang SH, Lin HC, Chang JB, Chan YS, Tang HF, Chang FY, et al. Preservation of red blood cell antigenicity in a new storage solution in vitro. Ann. Med. [Internet]. 2023; 55:168–174. Available in: https://doi.org/10.1080/07853890.2022.2157476
D'Alessandro A, Hod EA. Red blood cell storage: from genome to exposome towards personalized transfusion medicine. Transfus. Med. Rev. [Internet]. 2023; 37(4):150750. Available in: https://doi.org/10.1016/j.tmrv.2023.150750
Yoshida T, Prudent M, D'alessandro A. Red blood cell storage lesion: causes and potential clinical consequences. Blood transfusion = Trasfusione del sangue [Internet]. 2019; 17(1):27–52. Available in: https://doi.org/10.2450/2019.0217-18
Arif SH, Yadav N, Rehman S, Mehdi G. Study of Hemolysis During Storage of Blood in the Blood Bank of a Tertiary Health Care Centre. Indian J. Hematol. Blood Transfus. [Internet]. 2017; 33(4):598-602. Available in: https://doi.org/10.1007/s12288-016-0769-5
Igbokwe N. A review of the factors that influence erythrocyte osmotic fragility. Sokoto Journal of Veterinary Sciences. [Internet]. 2019; 16(4):1-23. Available in: https://doi.org/10.4314/SOKJVS.V16I4.1
Salvagno GL, Demonte D, Dima F, Bovo C, Lippi G. Stability of refrigerated whole blood samples for osmotic fragility test. Hematol. Transfus. Cell. Ther. [Internet]. 2020; 42(2):134-138. Available in: https://doi.org/10.1016/j.htct.2019.06.001
Ilić M, Ivković M, Radaković M, Spariosu K, Andrić N, Kovačević M, et al. Association of increased osmotic fragility of red blood cells with common systemic inflammatory diseases in dogs. Pak. Vet. J. [Internet]. 2023; 43(3):463-469. Available in: https://doi.org/10.29261/pakvetj/2023.048
Gerda BA, Skverchinskaya EA, Andreeva AY, Volkova AA, Gambaryan S, Mindukshev IV. A Comparative Analysis of Erythrocyte Osmotic Fragility across Vertebrate Taxa. J. Evol. Biochem. Phys. [Internet]. 2024; 60(4):1363-1384. Available in: https://doi.org/10.1134/S0022093024040094
Reed GB. Preservation of Red Blood Cells for Hemolytic Reactions. J. Infect. Dis. [Internet]. 1929; 45(4):247-254. Available in: https://doi.org/10.1093/infdis/45.4.247
WVU IACUC Guidelines: Blood Collection – Maximum Volumes and Fluid Replacement. IACUC 20-005. [Internet] [Accessed 15 Jan 2025]. 2023; Version 2. Available in: https://animal.research.wvu.edu/files/d/f050dd7d-efcf-4314-9b36-8c3f446a809d/blood-collection-guidelines.pdf
Aldrich KJ, Saunders DK, Sievert LM, Sievert G. Comparison of erythrocyte osmotic fragility among amphibians, reptiles, birds and mammals. Trans. Kans. Acad. [Internet]. 2006; 109(3):149-158. Available in: https://doi.org/10.1660/0022-8443(2006)109[149:COEOFA]2.0.CO;2
Drabkin DL, Austin JH. Spectrophotometric studies: I. Spectrophotometric constants for common hemoglobin derivatives in human, dog, and rabbit blood. JBC [Internet]. 1932; 98(2):719-733. Available in: https://doi.org/10.1016/S0021-9258(18)76122-X
Al-Qarawi AA, Mousa HM. Lipid concentrations in erythrocyte membranes in normal, starved, dehyrated and rehydrated camels (Camelus dromedarius), and in normal ram (Ovis aries) and goats (Capra hircus). J. Arid Environ. [Internet]. 2004; 59(4):675-683. Available in: https://doi.org/10.1016/j.jaridenv.2004.02.004
Shirke VG, Kandalkar YB, Tanpure MU. Assessment of body condition score as an indicator of nutritional status in Sangamneri goats. Int. J. Vet. [Internet] [Accessed 18 June 2025]. 2024; 9:128-130. Available in: https://www.veterinarypaper.com/pdf/2024/vol9issue3/PartB/9-3-26-361.pdf
Marin N, Moragon A, Gil D, Garcia-Garcia F, Bisbal V. Acclimation and Blood Sampling: Effects on Stress Markers in C57Bl/6J Mice. Animals [Internet]. 2023; 13(18):2816. Available in: https://doi.org/10.3390/ani13182816
Granados Zúñiga, J. Fragilidad osmótica de los eritrocitos de carnero en relación con su uso en el laboratorio clínico. Rev. Cost. Cienc. Méd. [Internet] [Accessed 1 July 2025]. 1993; 14:55-59. Available in: https://hdl.handle.net/10669/336
Forchetti O, Maffrand C, Vissio C, Boaglio C, Cufré G. Hipofosfatemia y fragilidad osmótica eritrocitica en cabras. Revista Electrónica de Veterinaria REDVET® [Internet] [Accessed 27 July 2025]. 2006; 7(1). Available in: https://www.redalyc.org/pdf/636/63612648002.pdf
Ferreira SL, Caires AO, Borges TDS, Lima AM, Silva LO, dos Santos WN. Robustness evaluation in analytical methods optimized using experimental designs. Microchem. J. [Internet]. 2017; 131:163-169. Available in: https://doi.org/10.1016/j.microc.2016.12.004
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Luis Miguel Águila-Pérez, Angel Aquino-Perna, Maylin Pérez-Bernal, Adria Fernández-Pérez, Carlos Hernández-Díaz

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Los autores retienen sus derechos:
a. Los autores retienen sus derechos de marca y patente, y tambien sobre cualquier proceso o procedimiento descrito en el artículo.
b. Los autores retienen el derecho de compartir, copiar, distribuir, ejecutar y comunicar públicamente el articulo publicado en la Revista de Veterinaria y Zootecnia Amazónica (REVZA) (por ejemplo, colocarlo en un repositorio institucional o publicarlo en un libro), con un reconocimiento de su publicación inicial en la REVZA.
c. Los autores retienen el derecho a hacer una posterior publicación de su trabajo, de utilizar el artículo o cualquier parte de aquel (por ejemplo: una compilación de sus trabajos, notas para conferencias, tesis, o para un libro), siempre que indiquen la fuente de publicación (autores del trabajo, revista, volumen, numero y fecha).






